|
研究テーマ
Basic Questionと取り組み
神経回路は、神経細胞の結合と機能的なシステム形成のための厳格な「設計図」と、個体ごとに内部・外部の環境変化に刻一刻と対応しその経験を蓄積できる「適応性・学習能力」という、「剛」と「柔」の性質を併せ持つ。特に後者の特性は、シナプスにおける電気的シグナルと化学的シグナルの絡み合いから成り立っている。
本研究室では、その一つ一つの素過程を同定し、そのダイナミクスを明らかにすることを通じ、脳の作動原理を明らかにしたいと考えている。
脳は1000億個の細胞から構成され、個体の生存と種の繁栄のための営為を調節する最重要器官である。脳の活動は、神経回路を構成するニューロン間の情報受け渡しにコードされている。ニューロン自身は決して受動的な細胞でなく、ニューロン活動の結果、細胞内シグナル経路を活性化し、特定遺伝子産物を誘導し、その結果として神経伝達物質放出過程や神経伝達物質受容体の機能修飾を短長期的に行う可塑的な性質を有している。
1個のニューロンには数万個のシナプスがあり、各々独立した入力を受ける。独立した数万個の入力が一つの神経核の遺伝子発現をどのように調節制御するのか。また一つの神経核で転写されたtranscriptの情報が、どのように再分配されて最終的に各シナプスへ伝達されるのか。またこのような情報変換を過不足なく実行可能な神経回路形成・シナプス形成を支配するルールは何か。
これらの根本的な神経科学の諸問題を解き明かすため、ここ数年来、グルタミン酸光融解法を用いた局所刺激法、遺伝子発現イメージング、単一シナプス蛋白相互作用解析などの新規解析手法を独自に開発しており、単一ニューロン生化学から単一シナプス生化学への脱皮を目指し、新規技術開発に努めている。その一方で、同定した素過程のin vivo個体における機能解析にも取り組んでいる。

具体的には現在、当教室では、
1)長期記憶の成立に関与する転写因子CREBの分子制御機構やシナプスから核へと核からシナプスへのシグナリングに関する研究
2)神経回路形成・シナプス形成を制御する分子機構に関する研究
3)神経活動依存的アクチン細胞骨格制御・調節機構に関する研究
を中心に研究活動を推進している。
今後の展望
新たな教室のセットアップ後、ようやく柱となるプロジェクトが軌道に乗り、CREBシグナリングのさらなる解明とともに、アクチン細胞骨格シグナリングの新たな調節機構の発見が具体的なongoing
researchとして進行している。神経ネットワーク機能修飾がいかに行われるのか、その分子機構と生理的意義を今後とも検討していきたい。これらの実験から、脳高次機能形成の根本的な分子原理の一端を明らかにし、記憶障害・認知症・精神疾患等の予防・進行阻害のための新たな創薬標的探索の端緒となることを期待したい。
こちらもご覧ください(PDFファイル)
1)長期記憶の成立に関与する転写因子CREBの分子制御機構やシナプスから核へと核からシナプスへのシグナリングに関する研究
長期記憶が成立するためには、シナプス伝達の場である樹状突起スパインにおけるシグナル伝達効率の上昇が持続的に維持されることが必須と考えられている。その分子機構として着目されているものの一つは、転写因子CREBを介したシナプス活動依存的遺伝子発現上昇に伴う入力特異的シナプス修飾である。CREBの関与はアメフラシからマウス・ラットに至る多くの動物種において確認されている、しかしながら、その本当の意義、すなわち、転写因子として生理的下流標的遺伝子群やシナプス活動依存的活性制御機構については、詳細はまだ明らかになっていない(Okuno
and Bito, AfCS/Nature Molecule Page, 2006)。
我々は、これまで、CaMKK-CaMKIVカスケードが興奮性海馬CA1錐体細胞における主要な活動依存的CREBリン酸化経路であることを世界に先駆けて示し、同時にCREBのリン酸化そのものよりもCREBリン酸化の持続性が神経活動パターンによって制御されることが下流の遺伝子発現に必須であることを証明した(Bito et al., Cell 1996; Deisseroth, Bito et al., Neuron, 1996; Bito et al., Curr. Opin. Neurobiol., 1997; Bito, Cell Calcium 1998)。さらに、NMDA受容体ならびにカルシウム電位依存性カルシウムチャンネルの中でもL型カルシウムチャンネル活性化が、CaMKIV活性化によるCREBリン酸化に重要であることを解明した(Mermelstein, Bito et al., J. Neurosci., 2000)。
CREBリン酸化の持続こそが活動依存的シグナルであることを示す事例として、小脳顆粒細胞のカルシウム依存的生存が上げられる。CaMKIVは小脳顆粒細胞において非常に強く発現していることが、長らくその意義は不明であった。フランスStrasbourg大Loeffler研究室からの派遣留学生Violaine Seeとの協同研究により、CaMKIV活性の維持による核内リン酸化CREB量の保持が小脳顆粒細胞の生存にとって必須であることが明らかになった(See et al., FASEB J., 2001)。
このようなデータにより、CaMKIVによるCREBリン酸化制御が、海馬錐体細胞における長期可塑性の発現以外にも、数多くの生理的意義を有していることを初めて明らかにしたものである。ほぼ同時期に、一部の遺伝性変性疾患の病因におけるCREB転写阻害の重要性が示されたこともあり、本発見は、CaMKIVによるCREBリン酸化機構が、生存制御により脳高次機能を司る神経回路網の長期的維持にも関与している可能性を示唆するものである(図1)(Bito
and Takemoto-Kimura, Cell Calcium, 2003)。
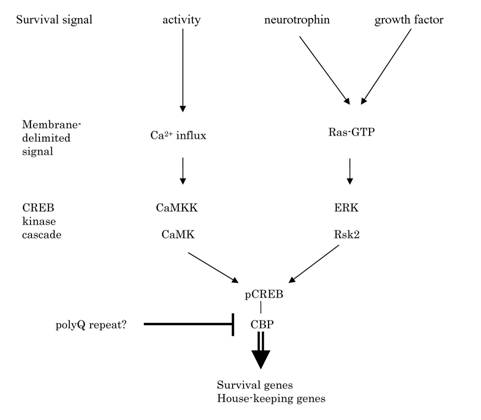
図1. CaMKシグナルの神経生存における役割の模式図
最近、CaMKIV/CREB経路と協調してCREB転写を制御する可能性を有する新たなリン酸化経路とそれに関与するリン酸化酵素を同定した(Ohmae
et al., submitted)。この新たなシグナル経路が「シナプスCa2+流入→CaMKIV活性化 →CREBリン酸化」に匹敵するシナプスから核へのシグナルルートなのか、CREB転写制御にどのような修飾をもたらすのか、その生理的意義は如何、などを探索中である。
一方、CREB転写に限らず、神経活動依存的に転写制御される生理的標的遺伝子の同定および機能解析が遅れている。我々は、可塑的シナプス活動により効率よく誘導される機能未知蛋白であるArcに焦点をしぼり、その神経活動依存的、シナプス入力特異的誘導の分子機序ならびに蛋白機能の解明をも進めている。
2) 神経回路形成・シナプス形成を制御する分子機構に関する研究
シナプス伝達受容は、シナプス後肥厚部に存在する神経伝達物質受容体とその受容体に結合して共役する受容体複合体により決定される。神経伝達物質受容体分子にはイオン透過型のものと、代謝共役型のものがあり、いずれも足場蛋白を介したシグナル蛋白複合体と共役にしていることが近年明らかになってきている。
我々は、興奮性伝達の主要な伝達物質であるグルタミン酸受容体のひとつであるNMDA受容体の足場蛋白であるPSD-95蛋白に低分子量G蛋白Rho関連蛋白Citronが結合することを見出し、シナプス膜の神経伝達物質受容体とアクチン細胞骨格を制御するRhoシグナル伝達系の間の密接な連関を示唆する初めての証拠を得た(Furuyashiki et al., J. Neurosci., 1999;Shiraishi et al., J. Neurosci., 1999)。
一方、われわれは、形態的に最も単純な神経細胞である小脳顆粒細胞に着目して、まず極性が生じ、2本の軸索がまず伸展し始め、その後に細胞体周辺に数多くの樹状突起が発生する過程(図2)を支配するシグナル経路の役割を探索した。
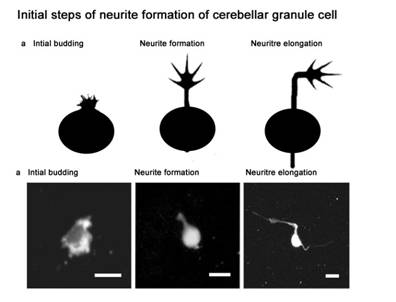
図2. 小脳顆粒細胞の突起進展機構
その結果、1)Rho/ROCK/LIMK経路が最初の突起形成のゲートとして働いており、その活性を阻害すると軸索形成が一挙に促進され、成長円錐ダイナミクスが亢進すること(Bito et al., Neuron, 2000)、さらに2)mDia1は、Rho下流のアダプター分子として軸索形成・突起伸展を促進させる活性を有することが明らかになった(Arakawa et al., J. Cell Biol., 2003; Bito, J. Biochem. 2003)(図3)。
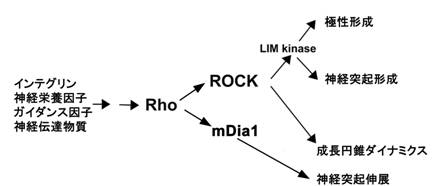
図3. ROCKとmDia1の協調による突起進展
これらの結果、突起形成・軸索伸展からシナプスにおける神経伝達物質局在制御に至るまで、一貫としてアクチン細胞骨格再編成が大きく寄与し、特にRhoファミリー低分子量
GTPaseの下流にある複数のエフェクターの協調的制御が不可欠ではないかということが示唆された。
このような考え方を検証する目的で、PSD-95の足場蛋白としての結合能を担うPDZモチーフの結合親和性を特異的に低下させた変異体を成熟神経細胞にて過剰発現させると、PSD-95のクラスタリング不全とともに、スパイン形態成熟不全が共存することが明らかとなった(Nonaka et al., J. Neurosci., 2006)。すなわち、morphogenesisの分子機構・シナプス蛋白局在のstoichiometry・スパイン成熟との間に、強い連関があることが確認された。
このような神経回路形成・シナプス形成に関わる遺伝子産物の機能障害が、ヒトの認知や脳高次機能の破綻に関与していることが最近提唱されている。従って、このような研究を推進し、得られた知見を基盤に一般原理が解明されれば、将来、分化神経細胞を目的部位に移動させ、軸索伸展やシナプス形成を自在に促進させるという、生理的分子機序に基づく機能的な神経回路再構築という新たな治療戦略が期待できるかもしれない。
3) 神経活動依存的アクチン細胞骨格制御・調節機構に関する研究
海馬錐体細胞の樹状突起スパインは、活動依存的な形態可塑性を引き起こすことが知られている。 我々は、GFPとアクチン分子の融合蛋白を作製し、adenovirusを用いて神経細胞に導入し、この過程で生じるアクチン細胞骨格の活動依存的再編成の可視化に初めて成功した。GFP-actin imagingを生きた初代培養海馬錐体細胞で行った結果、a)アクチン細胞骨格に動的な成分と静的な成分が共存すること、b)一定の条件下でスパインや細胞体辺縁膜へのアクチンの集積が神経活動依存的に引き起こされること、c)スパインへのアクチン移行はNMDA受容体依存的カルシウム流入により、また細胞体辺縁膜へのアクチン集積は、電位依存性カルシウムチャンネルにより特異的に引き起こされることを発見した(図4)(Furuyashiki et al., Proc. Natl. Acad. Sci. USA 2002)。
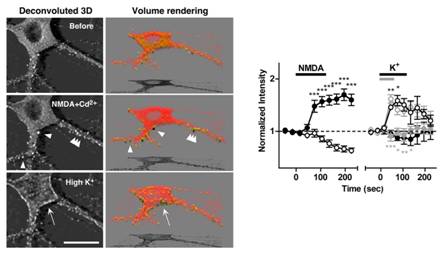
図4. NMDA刺激依存的アクチン集積のスパインへの誘導の可視化
上記の結果は、神経細胞骨格シグナリングが、神経回路の発生途上あるいは発達後を問わず、重要な役割を果しており、神経細胞の形態制御の時空間的ダイナミクスが高次脳機能に大きく寄与している可能性を強く裏付けるものである。
我々は、現在CaMKファミリーの中のいくつかの分子種が、カルシウム流入の下流で神経アクチン骨格制御に関与しているという可能性を追求している。特に注目すべきは、膜挿入型のCaMキナーゼであるCLICK-III/CaMKIgである。
CLICK-IIIは、膜局在シグナルであるC末端CAAX配列によりprenyl化修飾を受ける結果、Golgi膜および形質膜へ局在化する(図5)。このように脂質修飾を受け、膜移行を行う神経特異的キナーゼの存在を中枢神経系で発見したのは全く最初の例である(Takemoto-Kimura et al., J. Biol. Chem., 2003)。本知見は、神経細胞において、膜でのカルシウム流入部位の近傍にカルシウム・カルモデュリン標的キナーゼを局在化させ、excitation-phosphorylation couplingの効率を高めるための新たな分子機構を示唆するものである。
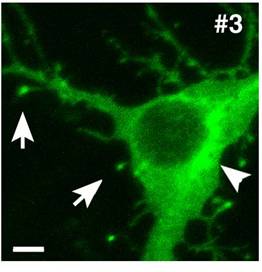
図5. 神経細胞におけるCLICK-IIIの膜局在
|